L’étude de la mitochondrie est une branche de la recherche médicale très récente. De nombreux chercheurs s’accordent d’ailleurs à dire que la médecine mitochondriale est celle de demain. Aujourd’hui, elle serait déjà en mesure de prolonger la vie en bonne santé. Les mitochondries et leur implication dans divers dysfonctionnements de l’organisme valent donc la peine d’être mis en lumière. Pourtant, les recherches mitochondriales si prometteuses sont encore trop méconnues aujourd’hui.
Que sont les mitochondries ?
Les mitochondries sont de petites structures présentes dans chacune de nos cellules, au nombre de 200 à 3 000 en fonction de la demande énergétique de l’organe. Elles sont indispensables à leur fonctionnement car ce sont elles qui sont à l’origine de la production d’énergie dans l’organisme. On peut dire que ce sont les « usines énergétiques » des cellules, qui leur fournissent toute l’énergie dont elles ont besoin pour assurer leur survie et les fonctions qu’elles accomplissent.
Outre la production d’énergie, les mitochondries sont aussi à l’origine du contrôle de la mort cellulaire programmée, ou apoptose. Il s’agit d’un mécanisme cellulaire au cours duquel les cellules indésirables ou nocives s’autodétruisent en réponse à un signal interne.
Ce processus sert normalement à réguler la taille des tissus et intervient dans de nombreux processus biologiques comme le développement embryonnaire et le fonctionnement du système immunitaire. Une dérégulation de la mort cellulaire programmée pourrait être impliquée dans de nombreuses pathologies comme des cancers, des maladies neurodégénératives, etc.
Les mitochondries participent également à de nombreux autres processus biologiques : synthèse hormonale, régulation de la température interne, maintien du taux de calcium…
Les mitochondries étant au cœur du fonctionnement de nos cellules, leur dysfonction peut être la source d’un mauvais métabolisme cellulaire et de diverses maladies que l’on peut qualifier de maladies mitochondriales.
Qu’est-ce qu’une maladie mitochondriale ?
On peut parler de maladie mitochondriale dès lors que les symptômes découlent d’un dysfonctionnement des mitochondries. Tous les organes peuvent être touchés puisque tous nos tissus renferment des mitochondries. Toutefois, les organes les plus demandeurs en énergie restent les plus affectés lorsque leurs mitochondries dysfonctionnent : cerveau, cœur, muscles, foie…
Quelles sont les causes des maladies mitochondriales ?
Il faut différencier les maladies mitochondriales primaires des maladies mitochondriales secondaires. Les maladies primaires, considérées comme des maladies rares, sont dues à une mutation innée de l’ADN mitochondrial (ADNmt) ou de l’ADN nucléaire codant pour des protéines mitochondriales (ADNn). Les maladies secondaires peuvent être des maladies communes, portant une dysfonction mitochondriale, dans la plupart des cas dus à une ou plusieurs mutations acquises au cours de la vie. Dans les deux types de maladies, les mutations impactent principalement le fonctionnement de la chaîne respiratoire au cœur de la cellule, entraînant ainsi une baisse significative de la production d’énergie1,2.
Le stress oxydatif est une des causes principales de l’apparition de dysfonctions mitochondriales3. L’oxygène présent dans l’air que nous respirons est une molécule indispensable à la vie. Néanmoins, durant le processus de respiration cellulaire (à savoir, le moment où la mitochondrie assimile la nourriture que nous mangeons en utilisant l’oxygène que nous respirons) se forment des molécules réactives appelées des radicaux libres. C’est d’ailleurs la mitochondrie qui génère environ 80 % des radicaux libres présents dans l’organisme, au travers de ses chaînes respiratoires principalement4. La formation de radicaux libres est inévitable au sein de l’organisme, et, en petites quantités, ces radicaux libres constituent même un mécanisme de défense naturel, dans la mesure où ils sont dirigés contre les éléments indésirables (bactéries, virus…).
Il est néanmoins important de limiter la formation de radicaux libres et de limiter leur propagation, sans quoi ils envahiront l’organisme, entraînant des dégâts mitochondriaux et cellulaires sur leur passage (mutations de l’ADN mitochondrial et nucléaire, altération des différents composants de la mitochondrie et de la cellule…). En plus d’une alimentation antioxydante, c’est principalement notre système de défense enzymatique interne qui prend en charge le stress oxydatif : SuperOxyde Dismutase (SOD), catalase (CAT) et glutathion peroxydase (GPx).
Les deux types de maladies mitochondriales
Les maladies mitochondriales primaires ou innées5,2
Les maladies mitochondriales primaires sont présentes dès la naissance et près de la moitié d’entre elles met en jeu le pronostic vital dans les premiers mois de vie. L’incidence de ces maladies est estimée à 1/4 000 naissances, soit environ 200 nouveaux cas par an, selon le centre de référence des maladies mitochondriales de l’enfant et de l’adulte (CARAMMEL).
Ces pathologies se manifestent à tout âge (majoritairement dans l’enfance ou l’adolescence) par des manifestations très variées au niveau de différents organes. Les personnes atteintes de maladies mitochondriales sont donc d’abord suivies par des médecins de spécialités variées : neurologues, diabétologues, cardiologues… Puis l’atteinte multiviscérale et l’aggravation des symptômes au cours du temps mettront ensuite plus ou moins rapidement sur la voie du diagnostic.
Ces pathologies se caractérisent principalement par une faiblesse et douleur musculaire, une intolérance à l’effort et une fatigue, mais également des problèmes oculaires, cardiaques, gastro-intestinaux ou des encéphalopathies. Ce groupe de maladies comprend des maladies plutôt rares mais invalidantes telles que le syndrome de Kearns-Sayre (KSS), le syndrome de Leigh, le syndrome d’acidose lactique et accidents vasculaires transitoires (MELAS), le syndrome d’épilepsie myoclonique avec fibres musculaires rouges déchiquetées (MERFF), le syndrome de neuropathie, ataxie cérébelleuse, rétinite pigmentaire (NARP), le syndrome de Pearson, l’ophtalmoplégie externe chronique et progressive (CPEO)…6
Le syndrome diabète-surdité de transmission maternelle (MIDD) fait également partie de ces maladies. Il provient d’une anomalie de l’ADN mitochondrial, ce qui implique que ce diabète est transmis par la mère. Il est souvent associé à une perte auditive. Sa présentation ressemble à celle du diabète de type II, il doit donc être correctement diagnostiqué afin d’être traité en conséquence.
Les maladies mitochondriales secondaires ou acquises

Ce sont des maladies plus communes et fréquentes. En effet, en France, les maladies impliquant une dysfonction mitochondriale sont sûrement les plus fréquentes des maladies métaboliques. Certaines données montrent qu’elle serait présente chez près d’une personne sur 2 500. Les chiffres sont toutefois amenés à augmenter étant donné que les connaissances sur les mitochondries et ses dysfonctions s’étendent. Il ne serait donc pas étonnant que la prévalence passe à une personne sur 20 voire sur 10².
Ces maladies résultent le plus souvent de mutations acquises au niveau de l’ADN mitochondrial, ou de l’ADN nucléaire, codant pour des protéines mitochondriales. Elles peuvent aussi, plus rarement, être issues de dommages affectant indirectement les mitochondries, inhibant certaines enzymes ou endommageant des composants de la mitochondrie elle-même. Ces mutations et dommages peuvent être induits par divers facteurs au cours de la vie : vieillissement, stress oxydatif, exposition à certains toxiques, tabagisme, médicaments (antidépresseurs, anxiolytiques, analgésiques, anti-inflammatoires, antibiotiques, anticholestérol, médicaments contre le diabète…).
Les symptômes de ces maladies apparaissent lorsque le nombre de copies de mitochondries touchées par une ou plusieurs mutations devient trop important et qu’il n’y a plus suffisamment de mitochondries saines au sein de la cellule.
Diverses pathologies connues peuvent avoir pour cause sous-jacente une dysfonction mitochondriale2 :
- Troubles cognitifs (Alzheimer, Parkinson, dépression, TDAH…)
- Troubles oculaires (cataracte, DMLA, glaucome…)
- Troubles cardiovasculaires (cardiomyopathies, détresse respiratoire…)
- Insuffisance hépatique
- Diabète
- Fibromyalgie
- Syndrome de fatigue chronique
- Infertilité
- Cancer
- Etc.
Les troubles cognitifs
Le cerveau consomme 20 % de l’énergie totale dont l’organisme a besoin. Le système nerveux est donc l’un des premiers systèmes à afficher des symptômes de déficiences énergétiques, et est le premier affecté en cas de stress métabolique. Plusieurs études corroborent le fait que les altérations fonctionnelles des mitochondries sont à l’origine de certaines pathologies neurodégénératives. Des maladies telles qu’Alzheimer, Parkinson, Huntington… seraient liées à un cercle vicieux de mutations de l’ADNmt, de déclin bioénergétique et de dommages induits par les radicaux libres au niveau neuronal7,8.
La production de neurotransmetteurs, leur libération et leur élimination requièrent de grandes quantités d’énergie. Ainsi, les mitochondries peuvent également être impliquées dans la pathogenèse de maladies touchant les processus liés aux neurotransmetteurs2 (dépression, TDAH…).
Une équipe de chercheurs a étudié les diverses causes possibles du syndrome de la fatigue chronique et a conclu que ce syndrome découlerait lui aussi d’une dysfonction mitochondriale9.
Les troubles cardiovasculaires
Les maladies cardiovasculaires sont une des principales causes de décès dans le monde. Les maladies telles que l’hypertension, la dysfonction diastolique ou encore l’ischémie découleraient toutes d’un déficit d’énergie mitochondriale. De plus, une déficience de production d’énergie par les mitochondries perturberait également le relâchement normal des muscles cardiaques2.
Les troubles oculaires
On sait que les dommages causés par les radicaux libres sont les facteurs les plus importants dans l’apparition de la dégénérescence maculaire liée à l’âge (DMLA). D’ailleurs, des mutations de l’ADNmt sont souvent retrouvées chez les patients touchés par cette pathologie2. L’atrophie optique dominante serait également due à des mutations d’un gène essentiel au bon fonctionnement des mitochondries10.

Le diabète de type II
Il a récemment été découvert que les mitochondries jouaient un rôle dans la pathogenèse du diabète de type II. Des dommages mitochondriaux portant atteinte aux cellules bêta du pancréas pourraient mener à une résistance à l’insuline11. En réponse, les cellules bêta du pancréas seraient donc obligées de produire davantage d’insuline. Ce phénomène, qui nécessite une plus grande quantité d’énergie, finirait par user les mitochondries présentes dans les cellules pancréatiques. À terme, les cellules bêta du pancréas en surrégime finiraient par mourir, entraînant ainsi la chute de la synthèse de l’insuline et une augmentation de la glycémie typiquement observée dans le diabète de type 22.
Les pertes auditives liées à l’âge
Un nombre croissant d’études suggère que les radicaux libres endommageraient l’ADN mitochondrial, entraînant l’apoptose des cellules de l’oreille menant à une perte auditive.
Infertilité et mitochondries12
Les ovocytes de femmes plus âgées contiennent une quantité importante de mutations de l’ADNmt qui altèrent leur fonctionnement. La division cellulaire dans l’embryon demandant de très grandes quantités d’énergie, les mutations de l’ADNmt sont alors incompatibles avec la perspective d’une fertilité normale et saine.
Aussi, le pouvoir fécondant du sperme est directement lié à l’activité mitochondriale. Il a été démontré que l’incubation du sperme de patients infertiles avec de l’ATP a amélioré le taux de fécondation in vitro.
Cancers
Les mitochondries contrôlent la fonction d’apoptose. Elles occupent donc une place primordiale dans l’élimination des cellules défectueuses et permettent d’éviter leur prolifération et la genèse d’un cancer. On retrouve dans les cellules cancéreuses 220 fois plus d’ADNmt muté que d’ADN nucléaire muté. Les mitochondries pourraient alors être utilisées comme marqueurs de cancers2.
Le vieillissement et les mitochondries
Il existe également un lien étroit entre le métabolisme mitochondrial aérobie, la génération de radicaux libres et l’état de sénescence13. Avec l’âge, l’activité et le nombre d’enzymes antioxydantes
Le déclin de la qualité et de l’activité des mitochondries, ainsi que la quantité accrue de radicaux libres ont largement été associés au vieillissement et au développement d’un large éventail de maladies liées à l’âge, qui peuvent alors être considérées comme des maladies mitochondriales secondaires.
Combien existe-t-il de maladies mitochondriales connues à ce jour ?
À ce jour, le nombre exact de maladies mitochondriales n’est pas établi. Et pour cause, la recherche sur les mitochondries n’était, jusqu’à ces dernières années, pas encore très développée. L’implication des mitochondries dans les pathologies est donc sous-évaluée mais la dysfonction mitochondriale serait la cause sous-jacente d’un grand nombre de maladies connues. On sait par ailleurs qu’il existerait plus de 300 maladies mitochondriales dues à des mutations de gènes nucléaires essentiels à la fonction mitochondriale14.
Comment réaliser le diagnostic d’une maladie mitochondriale ?
Ces pathologies restent encore difficiles à diagnostiquer, en raison du grand nombre de manifestations cliniques possibles qui peuvent faire penser à une multitude de maladies.
Les médecins qui ne connaissent pas bien les maladies mitochondriales ne penseront donc pas, de prime abord, au fait que la cause sous-jacente puisse être un dysfonctionnement des mitochondries.
Aussi, le diagnostic de la maladie peut arriver tardivement, car l’apparition de symptômes sévères dépend du taux de mutations mitochondriales. Comme dit précédemment, les premiers symptômes apparaissent lorsque le pourcentage de copies de mitochondries mutantes dans la cellule devient trop important, et qu’il n’y a plus suffisamment de mitochondries saines.
Le diagnostic de la maladie repose sur une observation clinique poussée et différentes analyses : électromyogramme, épreuve d’effort, biopsie musculaire, bilan des yeux, du cœur, du cerveau, bilan mitochondrial en laboratoires spécialisés…
Néanmoins, seules les études génétiques, à partir d’une prise de sang ou d’un prélèvement de muscle, permettent de poser le diagnostic avec certitude. Elles portent sur la totalité de l’ADNmt puis, en cas de négativité, sur des panels larges de gènes nucléaires. Ces recherches nécessitent de se rapprocher d’un centre spécialisé dans les pathologies mitochondriales.
Il reste donc globalement compliqué de déterminer une maladie mitochondriale. Néanmoins, la recherche sur la mitochondrie et son rôle dans les pathologies avance, ce qui semble présager une prise en charge plus efficace d’ici quelques années. Aujourd’hui, il est déjà possible d’agir sur la santé de nos mitochondries, aussi bien pour prévenir une éventuelle atteinte que pour soulager les manifestations liées à une véritable dysfonction mitochondriale.
Quelles sont les solutions envisageables ?
Généralement, les personnes atteintes par des maladies mitochondriales sont suivies par divers spécialistes (neurologues, cardiologues…) et seuls les symptômes sont traités. En effet, la plupart du temps, la pathologie n’est pas diagnostiquée comme ayant pour origine sous-jacente une atteinte mitochondriale. La maladie n’est donc pas vraiment traitée à sa cause, ce qui ne modifie pas de façon significative l’évolution de la pathologie.
De plus, même lorsque la maladie est diagnostiquée, elle reste très complexe à prendre en charge. À ce jour, il n’existe aucun traitement curatif pour les pathologies mitochondriales, quel que soit le type de maladie.
Il serait tout de même possible d’agir sur les différents processus pouvant dysfonctionner dans ces maladies grâce à des solutions naturelles.
 Les conseils hygiéno-diététiques
Les conseils hygiéno-diététiques
Il serait recommandé de suivre un régime cétogène, riche en bons lipides et pauvre en sucres, qui aurait montré des bénéfices thérapeutiques intéressants pour la prise en charge de maladies mitochondriales15.
Le jeûne intermittent serait également intéressant pour favoriser la mitophagie (élimination des mitochondries défectueuses) et la création de nouvelles mitochondries16.
La pratique d’une activité physique régulière d’intensité modérée est recommandée. Elle augmenterait le nombre de mitochondries17.
La relaxation et notamment la méditation stabiliserait des gènes impliqués dans la fonction mitochondriale18.
La micronutrition
Différentes équipes de chercheurs ont pu démontrer que l’apport de certaines molécules agissant sur les mitochondries permettrait d’aider à la prévention ainsi qu’à la prise de charge de certaines pathologies.
Ces molécules peuvent agir simultanément sur 3 axes :
- En optimisant la production d’énergie par les mitochondries afin d’optimiser le métabolisme général de l’organisme et d’atténuer les symptômes associés à un manque d’énergie mitochondriale
- En favorisant le renouvellement mitochondrial : élimination des mitochondries défectueuses et création de nouvelles mitochondries saines remplissant pleinement leurs fonctions
- En protégeant les mitochondries contre le stress oxydatif afin d’éviter les mutations
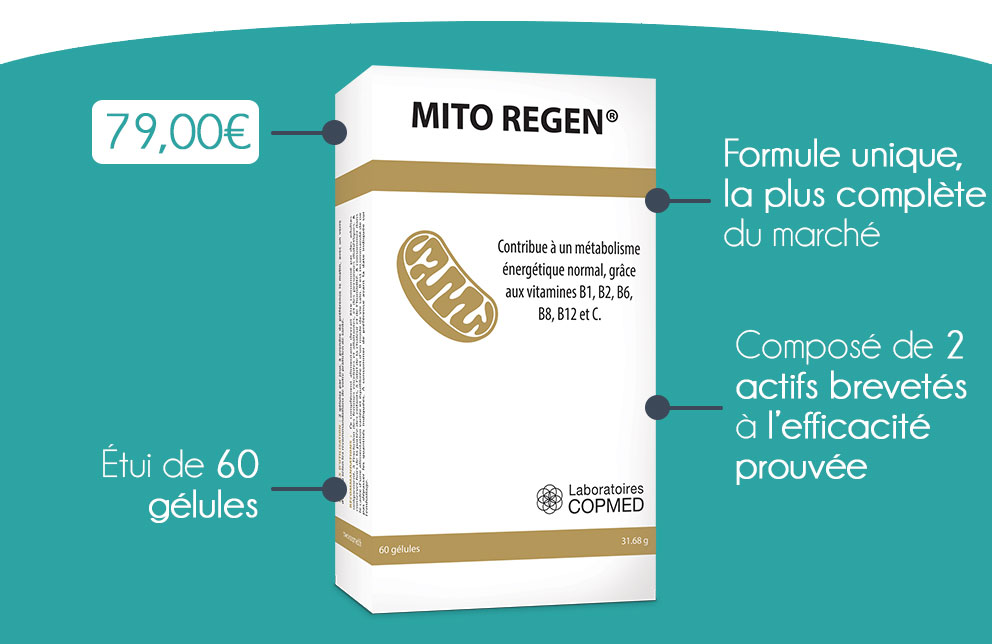
La CoQ10
La coenzyme Q10 est le cofacteur mitochondrial majeur. C’est lui qui transporte les électrons entre les complexes de la chaîne respiratoire qui produit l’énergie. Une quantité plus élevée de CoQ10 chez des sportifs due à une supplémentation en Ubiquinol a été significativement corrélée à des meilleures performances physiques (meilleure production d’énergie) et également des dommages musculaires moins importants, en lien avec les capacités antioxydantes puissantes de CoQ1019.
La supplémentation en CoQ10 serait efficace dans les pathologies avec un déficit primaire en CoQ10 (syndrome de Leigh par exemple)5.
Pour la maladie de Parkinson, l’administration de CoQ10, en association avec la Vitamine E s’est révélée efficace. Les améliorations plus prononcées étaient corrélées à l’administration de hautes doses de CoQ10 (1,200 mg/jour) et concernaient les activités de la vie quotidienne (réduction de 44 % du déclin fonctionnel)20.
L’équipe coordonnée par Diego Mastroeni au centre de recherche Banner a démontré que le CoQ10 est capable de protéger les mitochondries de la détérioration induite par une protéine bêta amyloïde qui pourrait favoriser la maladie d’Alzheimer. En effet, des plaques de cette protéine sont retrouvées dans la maladie d’Alzheimer. Le chercheur Johan Auwerx dont l’étude a été publiée dans Nature explique : « Nous avons montré que restaurer la santé mitochondriale réduit la formation de plaques – mais, surtout, cela améliore la fonction cérébrale, ce qui est l’objectif ultime pour tous les patients et les chercheurs dans l’Alzheimer. »21.
La L-ergothionéine
L’action la plus intéressante de la L-ergothionéine réside dans sa capacité à favoriser le mécanisme de mitophagie des mitochondries, c’est-à-dire la destruction des mitochondries fatiguées ou dysfonctionnelles22. En effet, la L-ergothionéine est activatrice de NRF2, un facteur favorisant la mitophagie23,24. Elle contribuerait également au transport des mitochondries usées vers l’extérieur de la cellule afin de laisser place aux mitochondries saines.
La L-ergothionéine favorise également la respiration cellulaire et augmente le métabolisme énergétique par oxydation des graisses25.
La PQQ (Pyrroloquinoline Quinone)
La PQQ permettrait de fabriquer une plus grande quantité d’énergie, notamment en activant la synthèse de nouvelles mitochondries26. Elle a également une capacité antioxydante. Une étude a pu exposer que des individus supplémentés en PQQ ont vu leurs teneurs en malondialdéhyde (marqueur permettant de détecter le stress oxydant) et en radicaux libres réduites27.
La L-carnitine
La carnitine permet de faire la navette des acides gras du cytoplasme vers la matrice mitochondriale, afin qu’ils soient béta-oxydés. Une disponibilité réduite de la L-carnitine induit une réduction
Il a été constaté que la L-carnitine inhibait la diminution de biosynthèse des mitochondries qui apparaît normalement avec le vieillissement. Elle permettrait aussi de diminuer les mutations de l’ADN mitochondrial liées à l’âge29.
L’acide R-alpha lipoïque
En tant que cofacteur de la pyruvate déshydrogénase (le pyruvate étant un métabolite intermédiaire dans le métabolisme énergétique), l’acide R-alpha lipoïque empêche l’accumulation de pyruvate dans la cellule ainsi que sa transformation en acide lactique. L’acide lactique est en effet connu pour entraîner une fatigue importante et des douleurs musculaires30.
Une étude a également démontré qu’une supplémentation en acide lipoïque a eu des effets bénéfiques sur le nombre de copies de mitochondries31.
Un essai clinique sur 63 personnes pendant 8 semaines a comptabilisé les activités de différentes enzymes antioxydantes, et la supplémentation en acide alpha-lipoïque a permis d’augmenter la fonction de la SuperOxyde Dismutase32.
La N-acétyl-cystéine
La N-acétyl-cystéine agit principalement sur le stress oxydatif. Une étude sur 50 hommes infertiles a montré une augmentation significative de la capacité antioxydante totale, après un traitement de 3 mois33. La supplémentation en N-acétyl-cystéine permettrait de prévenir l’oxydation au sein des mitochondries due aux radicaux libres, permettant ainsi de prévenir les dommages au niveau des reins34.
Les vitamines
Une étude a mis en avant une masse mitochondriale significativement augmentée chez des individus nourris avec la vitamine B335. Un essai clinique a démontré que la prise de vitamine B3 (précurseur du NAD et NADH) pendant 10 mois a permis de normaliser la quantité de NAD dans le muscle et dans le sang de patients atteints de maladie mitochondriale. Elle a également amélioré leur force musculaire et leur tolérance à l’effort36.
La vitamine B2 serait intéressante en cas de déficit du complexe I de la chaîne respiratoire, retrouvé dans la neuropathie optique de Leber et le syndrome MELAS37.
La vitamine B1 active les pyruvates déshydrogénases. Associée à l’acide alpha lipoïque, elle permet au pyruvate d’entrer dans la mitochondrie afin qu’il y subisse les transformations liées à la production d’énergie.
| Conclusion
Bien sûr, aucune molécule utilisée seule ne suffira, il semble que les meilleurs résultats proviennent d’une combinaison de plusieurs actifs, couplés à des mesures hygiéno-diététiques adaptées. Nous assistons aujourd’hui aux prémices de la recherche scientifique dans ce domaine fascinant. Il ne fait aucun doute que l’univers des mitochondries nous réserve encore de belles découvertes dans les années à venir. |
Références :
1. Bris C. Desquiret-Dumas V., et al. Pathologies liées à des mutations de l’ADN mitochondrial. Revue Francophone des Laboratoires. 2018. 2018(505) : 71-80
2. Know L. Les mitochondries au cœur de la médecine du futur. Editions Dangles. 2019.
3. Shigenaga MK and Hagen TM. Oxidative damage and mitochondrial decay in aging. Proc Natl Acad Sci USA. 1994. 91(23) : 10771-8
4. Turrens J. Mitochondrial formation of reactive oxygen species. J Physiol. 2003. 552(2) : 335-344
5. Chaussenot A., Rötig A., et al. Progrès dans les pathologies mitochondriales. 2011.
6. AFM Téléthon. Zoom sur la recherche dans les pathologies mitochondriales. 2018.
7. Damiano M. Thèse : Rôle de la dysfonction mitochondriale dans deux maladies neurodégénératives, la Maladie de Huntington et la Maladie de Parkinson. 2015.
8. Guillet-Pichon V. et Verny C. Mitochondrie et maladies neurodégénératives. Pratique Neurologique. 2016. 7 (2) : 117-122
9. Doctor Myhill S. Diagnosis and Treatment of Chronic Fatigue Syndrome and Myalgic Encephalitis. 2017. Disponible sur : https://www.drmyhill.co.uk/
10. Maloney D., Chadderton N., et al. Optimized OPA1 Isoforms 1 and 7 Provide Therapeutic Benefit in Models of Mitochondrial Dysfunction. Frontiers in neurosciences. 2020.
11. Gastaldi G. et Giacobino J.P. Syndrome métabolique, une maladie mitochondriale ? Revue médicale suisse. 2008.
12. May-Panloup Pascale., Chrétien MF., et al. Mitochondries et reproduction. Med Sci. 2004. 20 (8-9) : 779-783
13. Wei Y., Ma Y., et al. Mitochondrial theory of aging matures – roles of mt DNA mutation and oxidative stress in human aging. 2001. 64(5) : 259-270
14. Université de Nantes. Webinaire 5 : Les maladies mitochondriales. Disponible sur : https://www.youtube.com/watch?v=RGqzsSI2mjQ
15. Ahola-Erkkilä S., J Carroll C., et al. Ketogenic diet slows down mitochondrial myopathy progression in mice. Hum Mol Genet. 2020. 19 (10) : 1974-1984
16. Kim I., Lemasters JJ. Mitochondrial degradation by autophagy (mitophagy) in GFP-LC3 transgenic hepatocytes during nutrient deprivation. Am J Physiol Cell physiol. 2011. 300(2) :308-317
17. Ruiz M. Rôle de PGC-1α dans le système cardiovasculaire : recherche d’activateurs cœur-spécifiques et étude de ses mécanismes de régulation dans le muscle lisse aortique. 2011.
18. Bhasin M., Dusek J. et al. Relaxation Response Induces Temporal Transcriptome Changes in Energy Metabolism, Insulin Secretion and Inflammatory Pathways. Plos One. 2013. 12(2)
19. Sanchez Cuesta A., Cortez Rodriguez A., et al. High coenzyme Q10 plasma levels improve stress and damage markers in professional soccer players during competition. Int J Vitam Nutr Res. 2020. 1-12
20. Shults CW., Oakes D., et al. Parkinson Study Group, 2002. Effects of coenzyme Q10 in early Parkinson disease: evidence of slowing of the functional decline. Arch Neurol. 2002. 59(10) : 1541- 50.
21. Sorrentino V., Romani M., et al. Enhancing mitochondrial proteostasis reduces amyloid-β proteotoxicity. Nature. 2017.
22. Palikaras K., Lionaki E., et al. Interfacing mitochondrial biogenesis and elimination to enhance host pathogen defense and longevity. Worm. 2015. 4(3)
23. Hseu YC., Gowrisankar Y., et al. The Antiaging activity of Ergothioneine in UVA-irradiated human dermal fibroblasts via the inhibition of the AP-1 pathway and the activation of NRF2-mediated antioxidant genes. Oxidative medicine and cellular longevity. 2020.
24. Holmstöm K., Kostov R., et al. The multifaceted rôle of Nrf2 in mitochondrial function. Curr Opin Toxicol. 2016. 1 : 80-91
25. Webinaire Tetrahedron et site web. https://tetrahedron.fr/products/nutrition-ergoneine/
26. Hwang, P. S., Machek, S. B., et al. Effects of Pyrroloquinoline Quinone (PQQ) Supplementation on Aerobic Exercise Performance and Indices of Mitochondrial Biogenesis in Untrained Men. Journal of the American College of Nutrition. 2019. 1 10.
27. Zhou, X., Yao, Z., et al. PQQ ameliorates D-galactose induced cognitive impairments by reducing glutamate neurotoxicity via the GSK-3β/Akt signaling pathway in mouse. Scientific Reports. 2018. 8(1)
28. Marcovina, S. M., Sirtori, C., et al. Translating the basic knowledge of mitochondrial functions to metabolic therapy : role of L-carnitine. Translational Research. 2013. 161(2) : 73 84.
29. Nicassio L., Fracasso F., et al. Dietary supplementation with acetyl-l-carnitine counteracts age-related alterations of mitochondrial biogenesis, dynamics and antioxidant defenses in brain of old rats. Experimental Gerontology. 98 : 99-109
30. Walgren J., Amani Z., et al. Effect of R(+)alpha-lipoic acid on pyruvate metabolism and fatty acid oxidation in rat hepatocytes. Metabolism. 2004. 53 (2) : 165-173
31. M Santos J., Renu A., et al. Role of Mitochondria Biogenesis in the Metabolic Memory Associated with the Continued Progression of Diabetic Retinopathy and Its Regulation by Lipoic Acid. Investigative Ophtalmology and Visual Science. 2011. 52 : 8791-8798
32. Mahdavi R., Khabbazi T., et al. Alpha lipoic acid supplementation improved antioxidant enzyme activities in hemodialysis patients. Int J Vitam Nutr Res. 2019. 89(3-4) :161-167
33. Jannatifar R., Parivar K., et al. Effects of N-acetyl-cysteine supplementation on sperm quality, chromatin integrity and level of oxidative stress in infertile men. Reprod Biol Endocrinol. 2019. 17(1) : 24
34. Aparicio-Trejo, O. E., Reyes-Fermín, L. M., et al. Protective effects of N-acetyl-cysteine in mitochondria bioenergetics, oxidative stress, dynamics and S-glutathionylation alterations in acute kidney damage induced by folic acid. Free Radical Biology and Medicine. 2019. 130 : 379 396.
35. A Khan N., Auranen., et al. Effective treatment of mitochondrial myopathy by nicotinamide riboside, a vitamin B3. EMBO Mol Med. 2014. 6 :721-731
36. University of Helsinki. Niacin Supplementation in Healthy Controls and Mitochondrial Myopathy Patients (NiaMIT). 2019.
37. Parikh R., Saneto R., et al. A modern approach to the treatment of mitochondrial disease. Curr Treat Options Neurol. 2009. 11(6) :414-430

 Les conseils hygiéno-diététiques
Les conseils hygiéno-diététiques